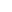|
- 起订量 (盒)价格
- 1-2¥1896 /盒
- ≥2¥1680 /盒
- 品牌:DM
- 产地:上海
- 型号:96T/48T
- 货号:DM-P5444
- 发布日期: 2023-12-20
- 更新日期: 2024-10-09
| 产地 | 上海 |
| 保存条件 | 2-8℃ |
| 品牌 | DM |
| 货号 | DM-P5444 |
| 用途 | 科研与实验 |
| 检测方法 | 吸附测定法 |
| 保质期 | 6个月 |
| 适应物种 | 猪 |
| 检测限 | 猪 |
| 数量 | 1000 |
| 包装规格 | 96T/48T |
| 标记物 | 电询 |
| 样本 | 血清,细胞,细胞上清液、体液等 |
| 应用 | 科研试剂 |
| 是否进口 | 否 |
小鼠胰素样肽2(GLP-2) ELISA 试剂盒
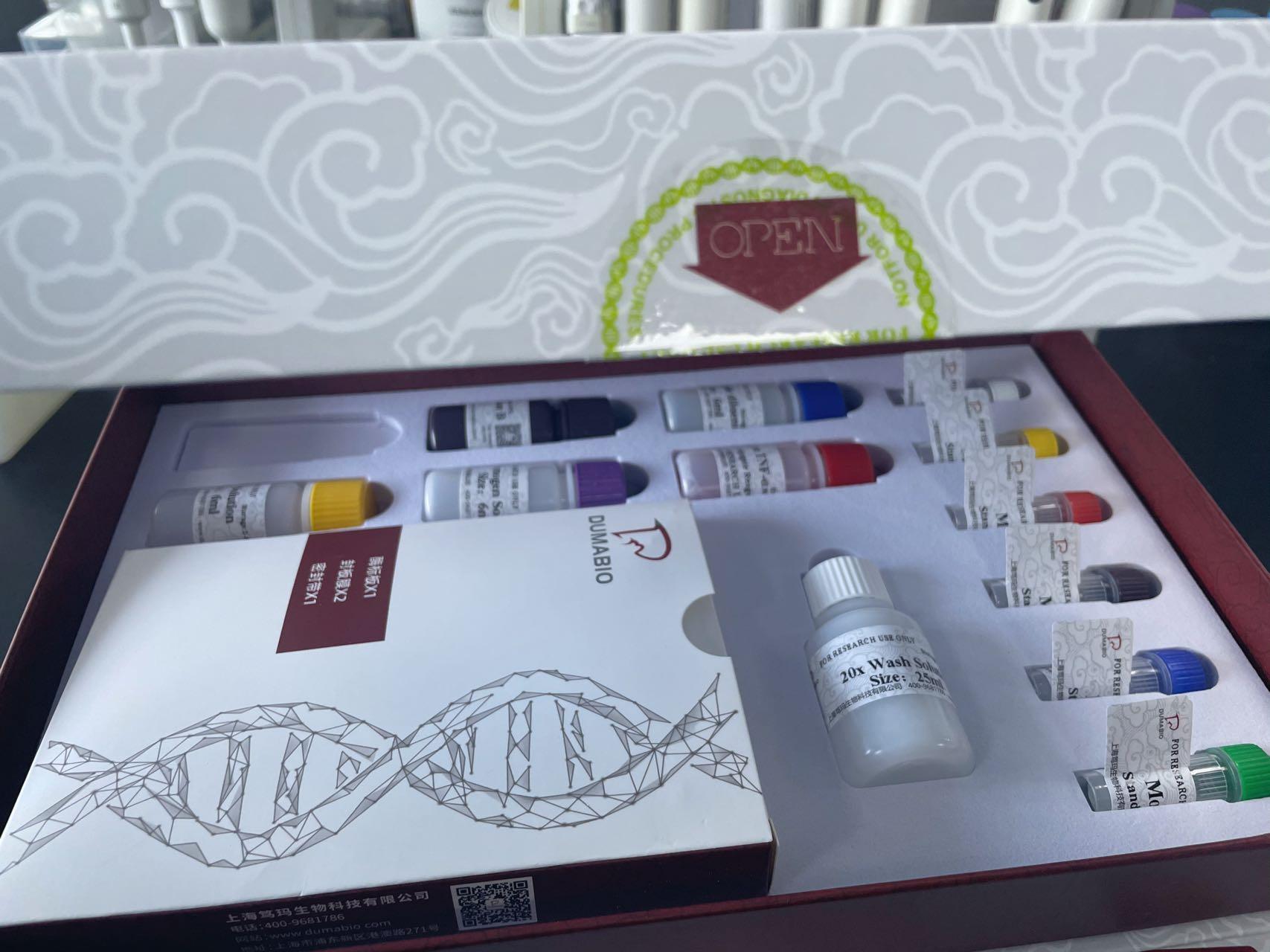
酶联免疫吸附实验 (ELISA) 是一种定性或定量检测,使用抗体来结合并测定目的分子。与其他免疫检测相似,可使用单克隆抗体和多克隆抗体来检测分析物(如肽、蛋白、抗体和小分子)。抗体对分析物产生特异性,并且一部分(如辣根过氧化物酶 [HRP])直接或间接偶联抗体,从而提供检测方法并实现可能的信号放大。通过多种ELISA方法和检测化学成份,可以让终端用户调整适当的检测,以解决预计的实验问题。该方法可以用于单份样品检测或高通量筛选。
直接 ELISA
在直接 ELISA 中,抗原直接结合微孔板表面,随后添加直接偶联的抗体来结合/检测。简而言之,实验步骤的 步便是将抗原固定在微孔板上。 步是添加一种封闭试剂,防止检测抗体出现非特异性结合。接下来,添加直接偶联某种酶(如 HRP)的检测抗体。该检测抗体将结合抗原,并且剩余的抗体会从孔中洗掉。随后添加这种酶的底物,短暂孵育后,通常在一个读板机上测定每个孔的信号。直接 ELISA 的实验步骤有限,可让实验设置整体简化。
直接法优缺点:
优点:1:快速,仅使用一种抗体且步骤较少;2:消除了 抗体的交叉反应性。
缺点:1:一抗的免疫反应性可能受到酶或标签标记的不利影响;2:为每个特定的ELISA系统标记一抗,既费时又昂贵;3:由于标记的抗体密度较低导致较低的灵敏度;4:抗原的固定化不是特异性的,有较高背景干扰。

间接 ELISA
间接 ELISA 类似于直接 ELISA;但主要的差别在于会通过 偶联抗体来检测结合抗体。实验步骤的 步便是将抗原固定在微孔板上。 步是添加一种封闭试剂,防止结合抗体出现非特异性结合。第三,添加一种抗原特异性结合抗体,短暂孵育后,用缓冲液洗涤板孔,以去除多余的试剂。下一步是“间接”检测,其中添加一种抗体来检测 结合抗体。这种抗体通常偶联某种酶。在孵育和洗涤板孔之后,添加该酶的底物。随后,短暂孵育后,通常在一个读板机上测定每个孔的信号。 抗体通常是一种抗物种抗体。间接 ELISA 的主要优势在于可以使用偶联的 抗体来进行多个实验,前提是在所有不同的实验中使用相同物种的结合抗体。另一个优势是 抗体会放大信号,因为大约 2 个抗体将结合 抗体。随着步骤数量的增加,实验步骤通常会耗时更长,并且更容易出错。此外,背景信号可能会增强,因为所需的试剂数量更多,每一种都可能会出现非特异性结合。
间接法优缺点:
优点:1:可以在一个物种中制备许多一抗,并且可以将相同的标记二抗用于检测;2:由于没有标记,保留了 抗体的 免疫反应性;3:高标记的二抗密度可实现高灵敏度,从而导致信号放大。
缺点:1:二抗可能会发生交叉反应,从而导致非特异性信号;2:这个过程中需要一个额外的孵育步骤
夹心法 ELISA
在夹心 ELISA 中,抗原成为 2 种抗体之间的“三明治”中心。在一种夹心 ELISA 形式中, 抗体被吸收进入微孔板孔中,在洗涤和封闭后,添加含抗原的样品。添加会结合样品分子另一位点的 抗体。这种 抗体通常偶联某种酶,因此它可用来检测。洗涤板孔之后,添加该酶的底物。随后,短暂反应孵育后,通常在一个读板机上测定每个孔的信号。
夹心法优缺点:
优点:1:高特异性,使用的捕获抗体与检测抗体都是检测特异性的;2:适用于复杂样品,抗原不需要进行纯化即可用于检测;3:灵活性更大,灵敏度更高,可采用直接法也可采用间接法。
缺点:1:检测物需要拥有两个以上不同的抗原表位或多个相同的重复表位:2:价格较贵,时间消耗多。
小鼠胰素样肽2(GLP-2) ELISA 试剂盒
竞争性ELISA
竞争性/抑制性 ELISA 也称封闭 ELISA,它对干扰预计信号的程度进行定量,以测定分析物的数量。这样做的一个方法是用一种对靶标有特异性的抗体包被平板。靶标可以偶联某种酶,并用于检测。如果实验含有次于 量的检测靶标,则高浓度的未标记靶标会竞争性地结合,从而减弱信号。这类竞争性实验可用来测定某种特异性分析物的水平。
竞争法优缺点:
优点:1:灵敏度高以及灵活性高;2:能测定微量的分析物。
缺点:1:特异性较低;2:需要酶标记的抗原。
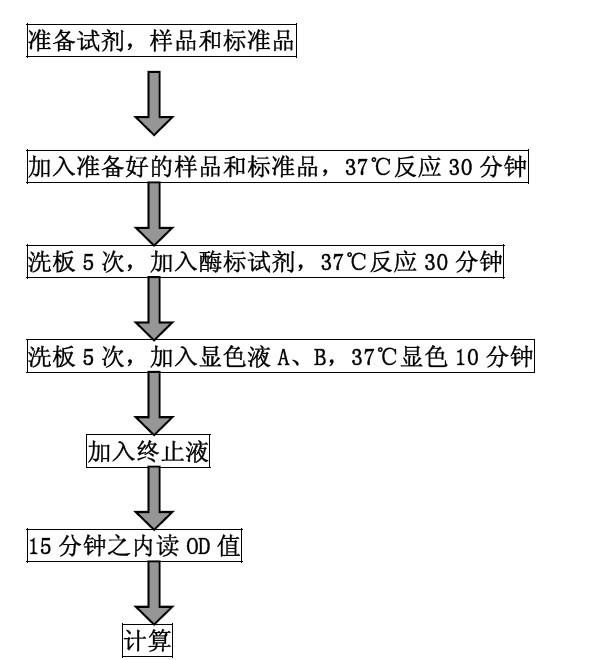
阻断ELISA
本法主要用于检测型特异性抗体。该方法现已成为猪(TGE)、猪伪(PR)及猪胸膜(AP)的主要检测方法。下面以AP2型抗体的阻断ELISA检测法为例介绍其操作程序:
① 100μl AP2型工作量抗原包被 → 4℃过夜,洗涤三次、抛干
② 用200μl阻断缓冲液进行封闭 → 37℃ 60分钟,洗涤三次、抛干
③ 加工作量1:4稀释被检猪血清100μl → 37℃ 60分钟,洗涤三次、抛干
④ 加100μl工作量兔抗AP2型血清 → 37℃ 30分钟,洗涤三次、抛干
⑤ 加100μl工作量猪抗兔IgG-HRP → 37℃ 60分钟,洗涤三次、抛干
⑥ 加100μl OPD底物液 → 37℃ 20分钟,加终止液
⑦ 用ELISA检测仪测定OD值。
本试验同时设标准阴、阳性血清对照、兔抗AP2型阳性对照、空白对照。
抗体捕捉ELISA
本法主要用于检测IgM抗体。由于IgM抗体出现于感染早期,所以检测出IgM,则可作为某种疾病的早期诊断。抗体捕捉ELISA根据所用标记方式不同可分为标记抗原、标记抗体、标记抗抗体捕捉ELISA等几种,其中以标记抗原捕捉ELISA比较有代表性,该方法的主要程序为:
① 用抗u链(抗IgM重链)抗体包被→37℃ 60分钟后置4℃过夜,洗涤三次、抛干
② 加待检血清 → 37℃ 2小时,洗涤三次、抛干
③ 加酶标抗原 → 37℃ 60分钟,洗涤三次、抛干
④ 加底物液 → 37℃ 20分钟,加终止液
⑤ 用ELISA检测仪测定OD值。
斑点ELISA
与常规的微量板ELISA比较,Dot-ELISA具有简便、节省抗原等优点,而且结果可长期保存;但其也有不足,主要是在结果判定上比较主观,特异性不够高等。该方法的主要操作程序为:
⑴载体膜的预处理及抗原包被 取硝酸纤维素膜用蒸馏水浸泡后,稍加干燥进行压圈。将阴性、阳性抗原及被检测抗原适度稀释后加入圈中,置37℃使硝酸纤维素膜 干燥。每张7cm×2.3cm的膜一般可点加40-53个样品,每个压圈可加抗原液1-20μl。
⑵ 封闭 将硝酸纤维素膜置于封闭液中,37℃感作15-30分钟。封闭液多采用含有正常动物血清、pH7.2或pH7.4的PBS。
⑶ 加被检血清 可直接在抗原圈上加,也可剪下抗原圈、置于微量板孔中,再加入一定量适度稀释的待检血清,37℃反应一定时间,用洗涤液洗三次,每次1-3分钟。洗涤液一般为一定浓度的PBS-Tween溶液。
⑷ 加酶标抗体,37℃反应一定时间后,用洗涤液洗三次。
⑸显色 加入新鲜配制的底物液,37℃反应一定时间后,去掉底物液,加蒸馏水洗涤终止反应。
⑹ 结果判定 以阳性、阴险血清作为对照,膜片中央出现深棕红色斑点者为阳性反应,否则为阴性反应。
布ELISA
(C-ELISA) C-ELISA(Cloth-ELISA)是加拿大学者Blais,B. W.等于1989年建立的一种新型免疫检测技术。该方法是以疏水性聚脂布(Hydrophobic Polyester Cloth)即涤纶布为固相载体,这种大孔径的的疏水布具有吸附样品量大,可为免疫反应提供较大的表面积,提高反应的敏感性,且容易洗涤,不需特殊仪器等优点。其基本原理与Dot-ELISA类似,只是载体不同。以对布氏杆菌抗原的检测为例,C-ELISA的主要程序为:
⑴ 首先把抗布氏杆菌的血清包被(吸附)在聚脂布上,并经洗涤及封闭;
⑵ 加被检样品并于室温下感作30分钟,然后洗5次;
⑶ 加酶标记的抗布氏杆菌抗体,于室温下感作30分钟,然后洗涤5次;
⑷ 加入底物液显色;
⑸ 测定OD值。
-
中秋迎好礼 中秋迎好礼 随着国产3A大作《黑神话:悟空》的面世,现我司推出活动。 从即日起至2024年9月18日,购买ELISA试剂盒满五盒,即可申领《黑神话:悟空》数字标准版兑换码。 ... VIEW DETAILS
-
化学实验室守则小分享 一、实验前 在进行化学实验前,学生必须完成预习工作,了解实验的目的、步骤和注意事项。进入实验室前,应穿着适当的防护装备,如实验服、护目镜、实验手套等。此外,学生应提... VIEW DETAILS
-
犬肾素(REN)ELISA试剂盒在宠物健康监测中的重要作用 随着宠物健康管理的日益受重视,犬肾素(REN)ELISA试剂盒在宠物健康监测中发挥着不可或缺的作用。 犬肾素作为一种关键的激素,其水平的变化能够反映犬只肾脏的功能状态。而犬肾素(REN)ELISA试... VIEW DETAILS
-
上海笃玛生物科技有限公司2024年春节放假通知 尊敬的新老客户: 您好! 2024年春节即将到来,上海笃玛生物科技有限公司全体员工提前恭祝广大新老客户,新春快乐、生意兴隆、万事如意!非常感谢您长期以来对我们工作的理解... VIEW DETAILS
-
科研基础小知识分享,细胞传代 一、什么是细胞传代? 细胞传代是细胞培养过程中的一项基本技术,是指将培养的细胞在一定的条件下进行分离、再培养的过程。传代过程中,细胞会逐渐生长,并填满整个培养容器,因此需要进... VIEW DETAILS
-
ELISA样品制备&收集指南 一、引言 酶联免疫吸附试验(ELISA)是一种广泛应用于生物学和医学研究的免疫分析方法。该方法通过将抗原或抗体固相化在载体表面,实现对目标分子的捕获和检测。在进行ELISA实验之前,... VIEW DETAILS